新冠病毒主要感染人的呼吸系统,可导致新冠病毒感染的肺炎,临床症状通常表现为发热、咳嗽、呼吸短促、全身疼痛及腹泻等。重症患者的症状可发展为急性呼吸窘迫综合征、代谢性酸中毒、感染性休克及凝血功能障碍,最终可导致多器官衰竭、甚至死亡。新冠病毒感染的一个重要的特征是,病毒感染能诱导机体产生强烈的免疫应答和炎症反应,导致大量细胞因子快速和过度表达,这种现象称为“细胞因子风暴”(Cytokine Storm)。细胞因子风暴能导致炎症反应失控,引起急性呼吸窘迫综合征、严重肺炎、肺组织损伤、甚至多器官衰竭。因此,细胞因子风暴可能是导致新冠肺炎重症和死亡的因素。
炎症小体(Inflammasome)是机体天然免疫系统的重要组成部分,根据不同的感应蛋白(Sensor Protein)而命名,炎症小体主要有四种类型:NLRP1、NLRP3、NLRC4和AIM2。其中,NLRP3炎症小体在RNA病毒感染中起着重要作用。NLRP3炎症小体由感应蛋白(NLRP3),衔接蛋白(ASC)及效应蛋白(Caspase-1)组成。在NLRP3炎症小体激活过程中,NLRP3 与ASC相互作用,促进ASC形成寡聚体,为半胱天冬酶-1(Caspase-1)活化提供场所;活化的半胱天冬酶-1通过自催化裂解形成,然后可催化前体促炎因子(Pro-IL-1β)水解为成熟IL-1β。但是,过量的IL-1β可以通过激活不同的信号通路、诱导系统性炎症反应,促进大量的细胞因子释放(包括IL-6、TNF、IFN-α、以及IFN-β等),产生细胞因子风暴,导致急性炎症性疾病。
吴建国教授团队近年来,聚焦RNA病毒感染调控NLRP3炎症小体、导致相关疾病的分子机制研究,取得了系列研究成果。发现登革病毒调控NLRP3炎性小体,促进IL-1b活化,诱导小鼠血管渗漏,导致组织损伤(Pan et al., Front Microbiol2019; Pan et al., J Virol2019;Pan et al., PLOS Pathog 2021)。确定寨卡病毒感染促进NLRP3炎症小体组装、诱导IL-1β分泌、激活宿主炎症反应(Wang et al., Nat Commun2018; Wang et al., Nano Lett2019; Li et al., Front Immunol2020)。证明肠道病毒71型感染激活NLRP3炎性小体,诱导炎症反应(Wang et al., PLOS Pathog2017; Luo et al., PLOS Pathog2017; Luo et al., PLOS Pathog2019)。
2021年8月2日,吴建国团队在Nature Communications《自然通讯》杂志上发表了题目为“SARS-CoV-2 N protein activates the NLRP3 inflammasome to induce hyperinflammation”的论文。

该研究揭示了新冠病毒N蛋白通过与NLRP3蛋白直接相互作用,促进NLRP3炎症小体的组装和活化,诱导细胞炎症因子过度表达,导致急性炎症和器官损伤的分子机制。通过深入研究发现,在急性炎症小鼠模型中,新冠病毒N蛋白能促进NLRP3炎症小体激活、加重肺组织损伤、加速小鼠死亡。新冠病毒N诱导的细胞因子过度表达和肺组织损伤,可以被NLRP3的抑制剂以及Caspase-1的抑制剂显著阻断。与NLRP3野生型(NLRP3+/+)小鼠相比,在NLRP3缺失(NLRP3-/-)小鼠中,新冠病毒N蛋白诱导的细胞因子过度表达和肺组织损伤明显受到抑制。这些研究结果证明,新冠病毒N蛋白和NLRP3炎症小体在新冠病毒感染导致炎症反应以及组织损伤中发挥了非常重要的作用。
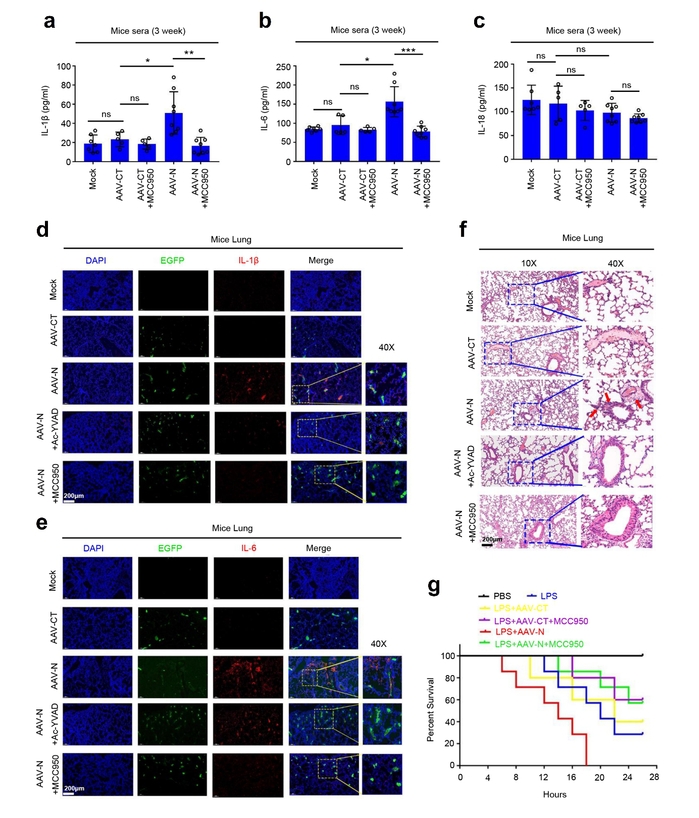
在小鼠体内,新冠病毒N蛋白通过激活NLRP3炎症小体、诱导小鼠肺损伤
因此,该研究成果揭示了新冠病毒感染引起急性呼吸窘迫综合征一种独特的分子机制,证实NLRP3炎症小体在新冠病毒感染导致过度炎症反应和肺损伤中的重要作用,提出新冠病毒N蛋白激活的“炎症因子风暴”可能是病毒感染导致急性肺炎和肺损伤的关键因素。进一步加深了人们对新冠病毒感染导致新冠肺炎的致病机制的认识。此外,提出NLRP3抑制剂和Caspase-1抑制剂有望成为防治新冠病毒感染的潜在药物,并且为防治新冠肺炎提供新的思路和理论依据。
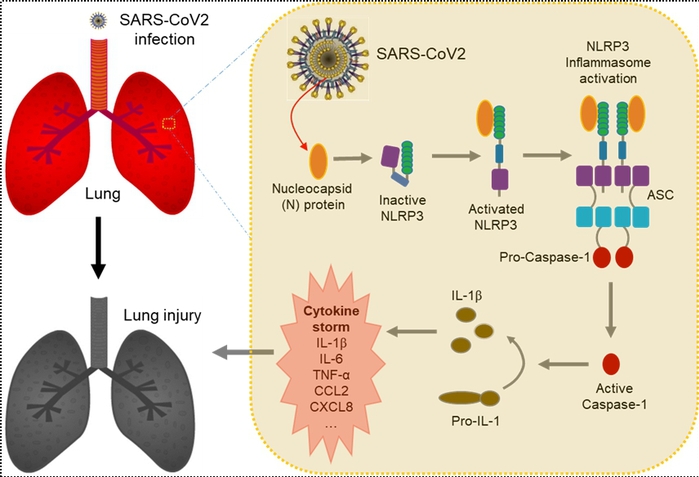
新冠病毒N蛋白通过与NLRP3互作,激活炎症小体,导致细胞因子大量产生和释放,诱发“细胞因子风暴”,加速组织损伤和重症肺炎进程
暨南大学吴建国教授为论文的通讯作者、李耿教授和李永奎副教授为论文的共同通讯作者,暨南大学博士后潘攀、武汉大学博士生申苗苗、武汉大学硕士生喻振阳为论文的共同第一作者。该项工作得到了国家自然科学基金重点项目、中国博士后基金等项目的资助。
论文链接:https://doi.org/10.1038/s41467-021-25015-6