丝胶是由桑蚕的丝腺分泌的、包裹在丝核外围的可溶性蛋白质,约占蚕丝总量的20–30%。近几十年来,丝胶的许多重要生物活性逐渐被人们发现。丝胶能促进细胞增殖、提高细胞粘附和迁移能力、提供细胞营养,可改善细胞生长和促进组织再生,还可用作细胞的冷冻保护剂、提高细胞复苏效率。丝胶已被改性以制备用于组织损伤修复以及体内药物递送的生物支架或药物载体。由于丝胶的抗氧化性、保水性和细胞支持性,已被开发成皮肤再生制剂和护肤品。因此,丝胶作为一种具有多种活性和良好生物相容性的生物材料,在生物医学工程领域具有广阔的应用前景。研究丝胶是否能提高细胞的抗病毒能力以防止病毒感染和致病具有重要意义。
干扰素激活的抗病毒天然免疫对宿主细胞限制病毒感染至关重要。干扰素的激活效率和表达水平决定了病毒感染的结果、感染引起细胞死亡和病毒清除。当病毒侵入宿主时,细胞模式识别受体(PRR)立即识别病原体相关分子模式,并激活下游信号转导途径,以启动干扰素的转录。RIG-I作为细胞PRR识别病毒RNA,RIG-I被病毒RNA激活,刺激MAVS聚集并在线粒体外膜上形成RIG-I-MAVS复合物,导致TBK1、IKKε和IRF3磷酸化。磷酸化IRF3作为一种活性转录因子进入细胞核启动干扰素表达。RIG-I介导的干扰素激活信号通路受各种因素影响,导致细胞抗病毒反应失败。然而,有些病毒成分能作为干扰素抑制物、促进病毒感染和复制。例如人肠道病毒71型(EV71)的3A和3C蛋白通过阻断RIG-I-MAVS通路损害I型干扰素的激活。新冠病毒(SARS-CoV-2)具有强大侵袭性的一个原因是多种病毒蛋白质(包括N、M和ORF9b等),可抑制RIG-I介导的干扰素激活。抑制干扰素活化也涉及到细胞内源因素,例如细胞糖酵解产生的乳酸可与MAVS结合,损害RIG-I-MAVS信号介导的干扰素激活。逆转这种免疫能力损伤的手段可作为预防和治疗病毒感染的有效方法。
2021年11月16日,暨南大学吴建国教授团队在国际权威性杂志《Applied Materials Today》《当代应用材料》上在线发表了题目为“Sericin and sericin-derived peptide alleviate viral pathogenesis in mice though inhibiting lactate production and facilitating antiviral response”的文章。

该研究揭示了蚕丝的丝胶对细胞抗病毒天然免疫反应的调控作用。在小鼠实验中,滴鼻给予丝胶的小鼠对水疱性口炎病毒(VSV)感染有很强的免疫力,病毒感染诱导的器官损伤显著降低,小鼠体内干扰素激活水平显著高于未给予丝胶的对照组小鼠。说明丝胶能有效提高细胞的抗病毒天然免疫反应。
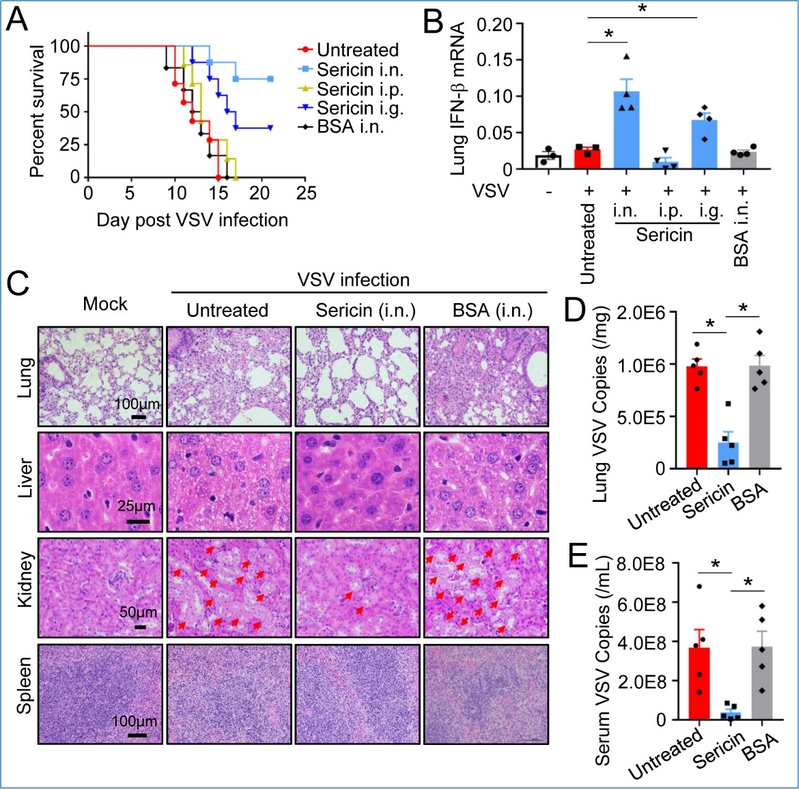
丝胶在小鼠体内抑制VSV感染
深入研究发现丝胶可促进细胞在病毒感染时激活干扰素的速度和效率,证明丝胶的抗病毒作用是通过改善细胞RIG-I通路活性来实现的,解释了丝胶为何对RNA病毒(VSV和EV71)有抑制效果,而对2种DNA病毒(乙型肝炎病毒:HBV和3型腺病毒:ADV-3)无显著作用。研究团队进一步测试了丝胶对细胞糖代谢类型和速率的影响。结果显示,丝胶能有效抑制糖酵解速率,减少胞内乳酸产生。外源补充过量乳酸的小鼠感染实验结果表明,丝胶是通过抑制内源乳酸产生来促进抗病毒反应。人体组织在缺氧条件下通过糖酵解产生乳酸,可能会抑制抗病毒天然免疫,增加病毒感染风险。因此,本研究表明丝胶蛋白可通过优化细胞糖代谢途径和速率来提高机体对病毒感染的免疫反应。
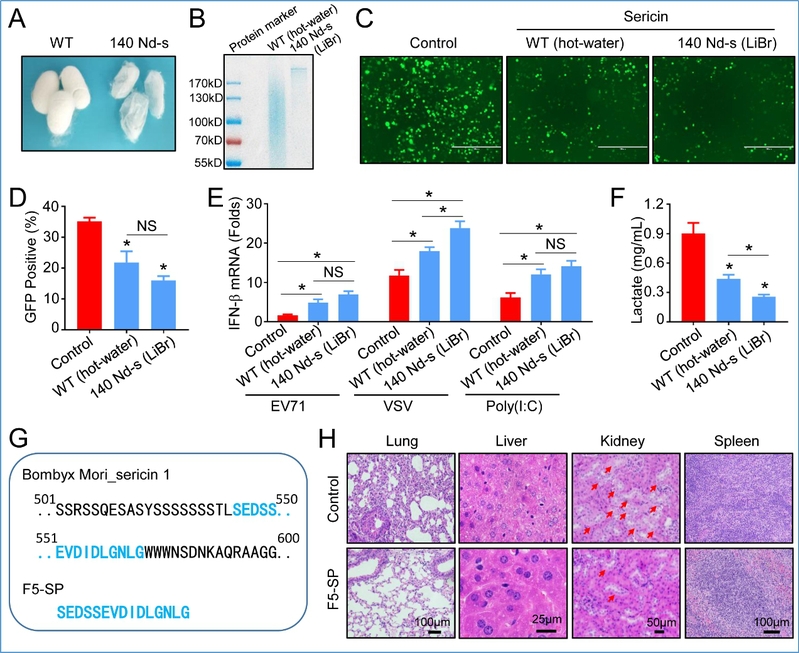
高纯度丝胶的提取和F5-SP多肽的抑制病毒效果
为了进一步阐明丝胶提高抗病毒免疫反应的方式,开发潜在的天然活性的抗病毒药物,研究团队合成了一种丝胶多肽(F5-SP),发现F5-SP多肽对病毒感染小鼠的器官损伤、干扰素激活具有与丝胶蛋白同等的功能,可抑制病毒感染,显著降低细胞糖酵解速率和乳酸生成。因此,研究团队提出了一种假设:F5-SP多肽的α糖苷酶抑制活性、降低细胞内葡萄糖的分解速度和糖酵解速率、提高细胞能量利用率。这一假设解释了已知的几种α糖苷酶抑制剂具有抗病毒活性的原因。
此外,研究团队对现有丝胶提取方法进行了改进,完全清除丝胶蛋白制剂中可能混有的内毒素,排除了内毒素对细胞免疫的影响。通过利用纯水提取法、丝素缺失突变蚕茧等技术手段,排除了蚕丝中另一种成分丝素对功效的影响。为科学研究和实际应用丝胶提供了创新性的技术支持。
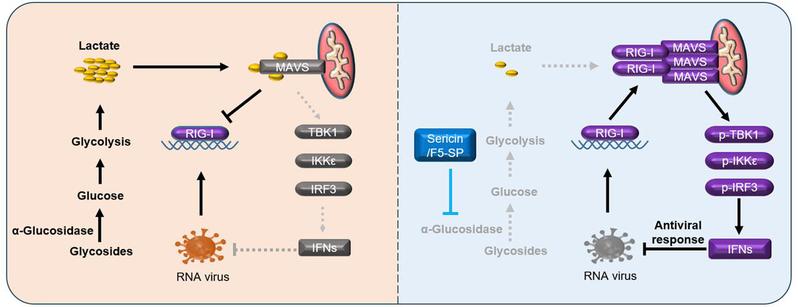
丝胶和F5-SP多肽的提高细胞抗病毒天然免疫反应的机制模式图
暨南大学吴建国教授为本论文的通讯作者,罗震副教授和邢曦雯副教授为论文的共同通讯作者;暨南大学副教授李永奎、硕士生黄颖和博士后潘攀为论文的共同第一作者。该项工作得到了国家自然科学基金、广东省自然科学基金等项目的资助。